Zink
Beschrijving
Zink is een essentieel spoorelement dat betrokken is bij processen in al onze lichaamscellen. In de dagelijkse praktijk hebben we er niet veel van nodig (<20 mg/dag), maar blijkt het desalniettemin onmisbaar voor het goed laten verlopen van veel lichaamsprocessen.
Zink fungeert als cofactor voor tal van enzymen (zinkbevattende metallo-enzymen), die een rol spelen in het metabolisme van eiwitten, vetten, nucleïnezuren en bij de regulatie van gentranscriptie. Het metaalion zink is vaak essentieel voor de enzymatische activiteit. Het kan enzymen activeren door als katalysator op te treden of door de structuur van enzymen of eiwitten te stabiliseren.
Op fysiologisch vlak is zink onmisbaar voor een juiste celdeling en groei, wondheling, eiwit- en koolhydraatstofwisseling, de aanmaak van energie en een goede communicatie met andere cellen in het lichaam.
Het lichaam kan zelf geen zink maken, waardoor we afhankelijk zijn van een dagelijkse inname via de voeding. Zink zit vooral in dierlijke, eiwitrijke bronnen, zoals vis, schaal- en schelpdieren, vlees en eieren. Het lichaam mist de capaciteit om zink op te slaan, maar beschikt wel over bepaalde regulatiemechanismen waardoor het zink kan herverdelen naar weefsels die veel zink verbruiken zoals botten, spieren en de huid.
Onvoldoende zinkinname komt frequent voor; naar schatting heeft maar liefst 17% van de wereldbevolking een zinktekort [1]. Dit kan gepaard gaan met symptomen als infecties, vertraagde groei en ontwikkeling bij kinderen, verminderde vruchtbaarheid en huidaandoeningen. Veel van deze symptomen zijn echter niet-specifiek en worden vaak in verband gebracht met andere gezondheidsaandoeningen. Zorg dragen voor een goede zinkstatus is voor iedereen van essentieel belang, in het bijzonder voor kinderen in de groei, zwangere vrouwen en ouderen.
Werkingsmechanisme
Zink is een belangrijk spoorelement dat deel uitmaakt van ongeveer 3000 eiwitten waarin het functioneert als een katalytisch, structureel of regulerend ion. Tal van enzymen en transcriptiefactoren (zoals bijvoorbeeld koolzuuranhydrase, superoxidedismutase (SOD) en metal-responsive transcription factor 1 (MTF-1) zijn voor hun activiteiten afhankelijk van zink. Dit maakt dat zink betrokken is bij veel verschillende cellulaire processen, zoals de eiwitsynthese, nucleïnezuurmetabolisme, gentranscriptie, celdeling en -differentiatie en mitose [2]. Hieronder worden een aantal functies van zink verder toegelicht.
Onderdeel van enzymen
Zink is onder andere nodig voor het enzym koolzuuranhydrase dat koolstofdioxide (CO2) en water (H2O) omzet in bicarbonaat (HCO3-) en waterstofionen (H+) en vice versa. Deze omzetting is cruciaal voor verschillende fysiologische processen zoals de pH-regulatie, ademhaling en het transport van CO₂ in het bloed.
Daarnaast zijn meer dan 100 enzymen die de eiwit- en koolhydraatstofwisseling reguleren afhankelijk van zink. Als cofactor voor het enzym koolzuuranhydrase is zink belangrijk voor de vorming van H+-ionen voor de productie van maagzuur, en ook voor de vorming van HCO3- (bicarbonaat) als buffer in de dunne darm om het maagzuur te neutraliseren. Bij een tekort aan zink, loopt een optimale maagzuurproductie en dus ook vertering al spaak. Ook andere spijsverteringsenzymen zijn zink-afhankelijk. Lees meer hierover in onze monografie ‘Spijsverteringsenzymen’[AF1] .
Zink is ook nodig voor de werking van de enzymen delta-5- en delta-6-desaturase (D5D en D6D) die betrokken zijn bij het vetzuurmetabolisme [3]. Onder invloed van deze enzymen worden vetzuren als linolzuur en alfalinoleenzuur omgevormd tot meervoudig onverzadigde vetzuren (PUFA’s). Deze vetzuren worden op hun beurt gemodificeerd tot fosfolipiden en, onder invloed van zink, op de juiste manier als bouwstof ingebouwd in celmembranen. Lees meer hierover in onze monografie ‘Omega-3 en omega-6 vetzuren’.
Zink maakt ook deel uit van enzymen en transcriptiefactoren die nodig zijn voor een goede celdeling (voor zowel de gewone celdeling, mitose, als de deling van de geslachtscellen, meiose). Het is van essentieel belang in allerlei fysiologische groeiprocessen en dus ook bij wondheling en reparatiemechanismen [4]. Voldoende zink is daarnaast cruciaal voor de spermatogenese, embryogenese en foetale groei [5,6].
Eiwitsynthese en DNA
Zink is essentieel voor een normale eiwitsynthese en vorming van nucleïnezuren. Zink ondersteunt het gehele proces van eiwitsynthese, van het stabiliseren van de ribosomen, fungeren als cofactor voor enzymen die betrokken zijn bij de eiwitsynthese, helpen bij de vouwing en stabiliteit van eiwitten, tot aan regulatie op transcriptieniveau. Als bouwstof is het onmisbaar in situaties zoals wondheling [4].
Zinkionen geven zinkvingereiwitten hun unieke driedimensionale ‘vingerachtige’ structuur waarmee ze bindingen kunnen aangaan met andere eiwitten, DNA- of RNA-structuren. [7]. De primaire functie van zinkvingereiwitten is hun vermogen om te fungeren als transcriptiefactoren. Ze binden zich aan specifieke DNA-sequenties en reguleren genexpressie door transcriptie te activeren of te onderdrukken. Zink is daarnaast, samen met magnesium, onderdeel van de chromatine structuur, dat bepaalt hoe DNA opgevouwen in de celkern ligt. Zink is ook onderdeel van antioxidatieve enzymen die DNA repareren wanneer het schade heeft opgelopen door zuurstofradicalen [8].
Antioxidantfunctie
Zink neutraliseert reactieve zuurstofdeeltjes doordat het de activiteit van verschillende antioxidanten, zoals glutathion, catalase en SOD, ondersteunt [9]. Deze enzymen vangen vrije zuurstofradicalen af en zetten deze om in waterstofperoxide en zuurstof alvorens ze schade kunnen aanrichten aan cellen. Het SOD-enzym is zowel afhankelijk van zink als van koper [10]. In de huid is het koper/zink SOD (Cu/Zn SOD) complex bijvoorbeeld erg belangrijk in het beperken van oxidatieve schade na blootstelling aan UV-straling [11]. Naast de essentiële rol van SOD in bescherming tegen oxidatieve schade, is het cruciaal voor de regulering van ontstekingsprocessen.
Zink faciliteert daarnaast de werking van onder meer de transcriptiefactor MTF-1 die de expressie van metallothioneïnen stimuleert. Metallothioneïnen zijn eiwitten die cellen beschermen tegen metaaloverbelasting en oxidatieve schade. De functie van MTF-1 bij immuunreacties blijkt daarnaast gerelateerd aan de activiteit van nucleaire factor-κB (NF-κB). De synthese van insuline hangt ook samen met de activiteit van deze transcriptiefactor en de zinkbalans [12].
Rol in immuunsysteem
Zink ondersteunt de complexe werking van het immuunsysteem [13]. Het speelt een rol in de activiteit en functie van verschillende immuuncellen van zowel het aangeboren immuunsysteem (macrofagen en natural killer [NK] cellen) als het verworven immuunsysteem (T-cellen en andere lymfocyten). Zo is zink bijvoorbeeld betrokken bij de rijping van T-cellen, dat deels wordt geregeld door het schildklierhormoon thymuline met zink als essentiële cofactor.
Zink beschikt daarnaast over anti-inflammatoire eigenschappen en doet dat deels door NF-ĸB signaleringsroutes te moduleren [10]. Het kan eveneens de immuunrespons reguleren door de afgifte van pro-inflammatoire cytokinen, zoals interleukine (IL)-6 en tumornecrosefactor (TNF)-alfa, te verminderen [6].
Hormoonhuishouding
Zink speelt een belangrijke rol in het endocriene systeem [2]. Het is bijvoorbeeld nodig voor de vorming en structurele stabiliteit van insuline ten behoeve van de glucoseregulatie. De bètacellen van de pancreas bevatten dan ook significant hogere concentraties aan zink dan andere cellen van het lichaam. Zinkionen beïnvloeden de insulinesignaleringsroute en stimuleren onder meer lipogenese en glucoseopname in de adipocyten [14]. Zink is daarnaast nodig voor een normale schildklierfunctie. Zink reguleert de synthese van het thyreotropinevrijmakend hormoon (TRH), het schildklierstimulerend hormoon (TSH) en de schildklierhormonen [15]. Verder reguleert zink het hormoon gastrine, dat de afgifte van maagzuur stimuleert en vertering bevordert.
Zenuwstelsel
Zink is belangrijk voor de normale ontwikkeling en werking van het centrale zenuwstelsel [16]. Het is noodzakelijk voor een juiste vorming van de neurale buis, proliferatie van stamcellen en neurotransmitteractiviteit [16]. Zink is een belangrijke regulator van de NMDA-receptor gevoeligheid. Het bindt namelijk aan de receptor waardoor de NMDA-receptor wordt gedeactiveerd. Zink werkt hierin samen met magnesium. Alleen als beide mineralen binden met de receptor wordt deze gedeactiveerd. Op deze manier verhindert zink in samenwerking met magnesium de afscheiding van neurotransmitters en remt het zenuwimpulsen [17,18].
Bronnen
Zink is, na ijzer, het op één na meest voorkomende spoorelement in ons lichaam. We halen zink uit zowel dierlijke als plantaardige voedingsmiddelen. Vooral dierlijk en eiwitrijk voedsel is rijk aan zink. Oesters bevatten veel zink, maar ook andere schaal- en schelpdieren, (orgaan)vlees, eieren en gevogelte zijn goede zinkbronnen. Ook dierlijke zuivel bevat zink. Humane melk (colostrum) bevat echter veel meer zink en wordt beter opgenomen dan zink uit koemelk [19].
Rijke plantaardige zinkbronnen zijn bonen, (pecan)noten en zaden (zoals pompoenpitten) [20]. De biologische beschikbaarheid van zink uit granen en plantaardige voedingsmiddelen is echter lager dan die van dierlijke voedingsmiddelen [20]. Bij de verfijning (raffinage) van granen gaat tot 80% van het zink verloren, omdat zink vooral aanwezig is in de buitenschil. Daarbij komt dat antinutriënten zoals fytaten/fytinezuur in volkorenbrood, granen, zaden, peulvruchten en andere voedingsmiddelen binden aan zink waardoor ze de opname van zink verminderen [21,22]. Ook oxalaten aanwezig in bepaalde groenten (rabarber, spinazie, bieten) en tanninen(koffie, thee, cacao en in onrijp fruit) hebben deze eigenschap. Ook de opname van andere mineralen kan door de aanwezigheid van antinutriënten beperkt worden.
Stofwisseling
Tijdens de spijsvertering komt zink in het darmlumen vrij uit voedsel als vrije Zn2+-ionen. Zinkopname vindt voornamelijk plaats in het jejunum (nuchtere darm/middelste gedeelte) van de dunne darm [23]. De absorptie van zinkionen in de dunne darm gebeurt onder invloed van zinktransporters die zich in de membraan van de enterocyten bevinden. Er zijn twee belangrijke typen zinktransporters: de ZIP en de ZnT transporters [24].
Normaliter is de opname van zink uit onze voeding ongeveer 15-40%. Als de zinkstatus in het lichaam te laag is, kan het lichaam dit verhogen tot wel 92%. De snelheid van opname is onder andere afhankelijk van de hoeveelheid transporteiwitten op het oppervlak van de dunnedarmwand. Zinkopname wordt negatief beïnvloed door de aanwezigheid van andere mineralen zoals koper, ijzer en chroom [25,26]. Er is dan sprake van competitieve remming.
Verdeling en homeostase
Na de opname van zinkionen door enterocyten in de dunne darm, wordt zink de portale circulatie in getransporteerd waarin het vooral gebonden is aan citraat, albumine en transferrine [2]. Via de lever bereikt zink de systemische circulatie en wordt verspreid naar perifere weefsels. Weefsels met hoge zinkconcentraties zijn de skeletspieren (60%), het bot (30%) en de huid (5%) [27].
De zinkwaarden in weefsels en cellen wordt gereguleerd door beide typen zinktransporters en het eiwit metallothioneïne. De hoeveelheid zinktransporters op het celmembraan gaat omhoog naarmate de hoeveelheid zink in het cytosol daalt, dit is een relatief snelle manier om de cellulaire zinkstatus te regelen [28]. Metallothioneïne is een metaalbindend eiwit, met een hoge affiniteit voor zink, en bijvoorbeeld ook koper. Het bevindt zich in de cel en door zink te binden is zink niet meer vrij beschikbaar [29]. Het lichaam kan zelf geen zink opslaan, maar door deze mechanismen kan het wel een bepaalde hoeveelheid zink bufferen en zorgen voor behoud van cellulaire homeostase.
Een tekort aan zink in de voeding kan een herverdeling van zink in cellen en weefsels veroorzaken. De lever, bot en testes kunnen dan zink verliezen om andere weefsels van zink te voorzien [30]. Andere organen zoals de huid, skeletspieren, het hart en de nieren behouden hun zinkniveaus daarentegen in zinkdeficiënte situaties [31].
Uitscheiding
Zinkhomeostase wordt op fysiologisch niveau behouden door balans tussen de opname en uitscheiding. Van het zink dat uit het lichaam wordt uitgescheiden, gaat ongeveer 50% verloren via de ontlasting [32]. De rest verlaat het lichaam via urine, zweet, menstruatie, sperma, haar- en nagelverlies en huidafscheiding. Bij een zinktekort, wordt de uitscheiding via de ontlasting en urine snel verminderd. De halfwaardetijd van zink bij de mens is ongeveer 280 dagen [33].
Behoefte en tekorten
Zink is een belangrijk spoorelement in ons lichaam. Een volwassen lichaam bevat gemiddeld tussen de 1,4 en 2,3 gram zink [10]. Zink kan niet door het lichaam zelf worden aangemaakt of opgeslagen; dagelijkse toevoer is daarom essentieel.
Behoefte
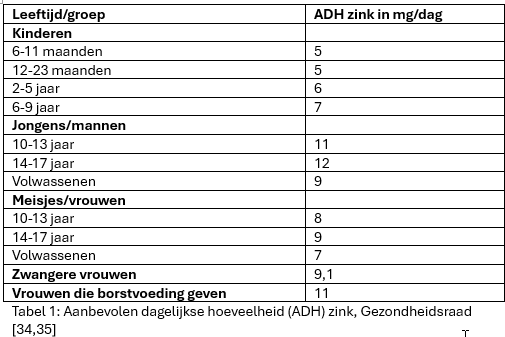
In Tabel 1 staat de aanbevolen dagelijkse hoeveelheid (ADH) die door de Gezondheidsraad is vastgesteld voor zowel kinderen, volwassenen als zwangere vrouwen en vrouwen die borstvoeding geven [34,35].
Uit de voedselconsumptiepeiling van het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) over de periode 2019-2021 blijkt dat de inname van zink uit voedingsmiddelen door volwassen mannen gemiddeld 11,7 mg/dag was en voor volwassen vrouwen gemiddeld 9,0 mg/dag. Met suppletie is de inname gemiddeld 13,4 mg/dag voor volwassen mannen en 11,1 mg/dag voor volwassen vrouwen [36]. Zonder suppletie zit dit boven de ADH. Waar echter geen rekening mee wordt gehouden is de hoeveelheid fytaten/fytinezuur of andere antinutriënten in de voeding die de zinkabsorptie remmen.
De European Food Safety Authority (EFSA) geeft een range van gemiddelde behoefte waarbij wel rekening wordt gehouden met het remmende effect van fytaten/fytinezuur in de voeding op de zinkabsorptie [37]. De aanbevolen dagelijkse hoeveelheid (gemiddelde behoefte) varieerde van 6,2 tot 10,2 mg/dag voor vrouwen met een referentielichaamsgewicht van 58,5 kg en van 7,5 tot 12,7 mg/dag voor mannen met een referentielichaamsgewicht van 68,1 kg; de geschatte gemiddelde behoefte varieerde van 2,4 mg/dag bij zuigelingen van 7-11 maanden tot 11,8 mg/dag bij adolescente jongens.
De richtlijnen houden echter geen rekening met de individuele zinkstatus en behoefte. Bovendien zijn er, naast antinutriënten in de voeding, nog tal van andere verstorende factoren die de zinkabsorptie of stofwisseling verstoren.
Risicofactoren
Factoren die de zinkbehoefte en daarmee ook het risico op een zinktekort verhogen zijn: ziekten, infecties, verwondingen, zwangerschap, frequente ejaculatie, ouderdom, maar ook intensieve sportbeoefening en frequente ejaculatie. Daarnaast kan een hoge inname van bewerkt voedsel (zoals bijvoorbeeld geraffineerde granen, suikers en verzadigde vetten, en zinkbindende fosfaten uit frisdranken), antinutriënten in de voeding, hoge inname van koper, het behouden van een balans met ijzer/mangaan/koper en langdurige blootstelling aan giftige stoffen (pesticiden) een beroep doen op de zinkstatus.
Tevens is gebleken dat kwikresiduen in ons voedsel het zinkmetabolisme verstoren en de zinkbehoefte vergroten. Kwikresiduen worden gevonden in het zoetmiddel HFCS (High Fructose Corn Syrup) dat veel gebruikt wordt in limonade en koek. Vooral zenuwcellen in het zich ontwikkelende brein van kinderen zijn extra gevoelig voor het giftige kwik.
Risicogroepen
Rokers en alcoholisten
Rokers hebben een verhoogd risico op een chronisch zinktekort, omdat cadmium uit sigarettenrook een antagonist is van zink [38]. Ook bij alcoholisten wordt vaak een zinktekort geconstateerd [39,40]. Ongeveer 30% tot 50% van de mensen die verslaafd zijn aan alcohol hebben een verlaagde zinkstatus. Dit komt doordat ethanol de zinkopname belemmert en zinkuitscheiding verhoogt [41]. Daarnaast is de voedselinname bij de zware alcoholist vaak beperkt en arm aan nutriënten waardoor de zinkopname nog minder kan zijn [20,42,43].
Vegetariërs en veganisten
Een strikt vegetarisch voedingspatroon bevat over het algemeen te weinig opneembaar zink voor het menselijk lichaam [44]. De zinkinname van vegetariërs en veganisten blijkt niet lager te zijn dan die van niet-vegetariërs. Wél is de zinkbehoefte bij deze groep tot 50% hoger vanwege de lagere biologische beschikbaarheid van zink uit plantaardige voeding en de aanwezigheid van antinutriënten [45]. Vegetariërs hebben soms wel 50% meer van de dagelijks aanbevolen hoeveelheid zink nodig dan niet-vegetariërs [20].
Ouderen
Ouderen hebben gemakkelijker een zinktekort door een combinatie van factoren: verminderde opname in het spijsverteringsstelsel, onvoldoende inname van zinkrijke voedingsmiddelen, medicatiegebruik, chronische ziekten, en een verhoogde behoefte aan zink voor immuunondersteuning en celregeneratie. Zinkdeficiëntie komt onder ouderen daarom veel voor. In twee Europese studies had 30-44% van de ouderen (boven 60-65 jaar) een te lage zinkinname [46,47].
Zwangere vrouwen en vrouwen die borstvoeding geven
Zwangere vrouwen, met name degenen die aan het begin van de zwangerschap al een (marginaal) zinktekort hebben, lopen een verhoogd risico op een verder oplopend zinktekort [48]. Daarnaast kan het geven van borstvoeding de maternale zinkstatus negatief beïnvloeden [49]. Net als voor vele andere macro- en micronutriënten geldt dat de zinkbehoefte voor zwangere en lacterende vrouwen is verhoogd omdat zink essentieel is voor de groei en ontwikkeling van de foetus en het herstel en de groei van weefsels bij de moeder [20].
Baby’s
Moedermelk levert voldoende zink (2 mg/dag) gedurende de eerste 4 tot 6 maanden. Zuigelingen tussen de 7 en 12 maanden hebben een hogere zinkbehoefte (3 mg/dag) waar via de borstvoeding lang niet altijd aan wordt voldaan [50]. Naast moedermelk moeten zuigelingen in de leeftijd van 7-12 maanden geschikte voedingsmiddelen of zinkformules gebruiken [20]. Sommige kinderen met een lichte tot matige groeistoornis en een zinktekort kunnen gebaat zijn met zinksuppletie [51,52].
Mensen met maag- en darmklachten en andere ziekten
Bij mensen met spijsverteringsstoornissen (zoals colitis ulcerosa, de ziekte van Crohn en het kortedarmsyndroom) of na maagdarmchirurgie kan de zinkopname in de darmen verminderd zijn en het zinkverlies verhoogd [53,54]. Andere aandoeningen die verband houden met een zinktekort zijn onder meer het malabsorptiesyndroom, chronische lever- en nierziekten, sikkelcelziekte, diabetes en maligniteiten [51]. Chronische diarree leidt ook tot overmatig verlies van zink [55].
Zinktekorten
Een verworven zinktekort kan ontstaan door een verminderde inname, het onvermogen om zink te absorberen, een verhoogde behoefte of overmatige uitscheiding. Een zinktekort vormt wereldwijd een groot gezondheidsprobleem. In ontwikkelingslanden ligt de prevalentie rond de 20% en is voor een groot deel toe te schrijven aan ontoereikende voeding [1]. Ook in de Westerse wereld kampt een groot deel van de populatie met een inadequate zinkstatus (gemiddeld rond de 10%) [1]. Zelfs bij ogenschijnlijk gezonde kinderen (1-3 jaar oud) in drie welvarende Westerse landen bleek maar liefst 31% een zinktekort te hebben [56].
Zelfs geringe zinktekorten kunnen zorgen voor een herverdeling van zink in het lichaam, waarbij de lever, botten en testes zink afstaan aan andere weefsels. Symptomen van een zinktekort bij kinderen zijn dan ook typisch zichtbaar in lever-, bot- en testesweefsel. Zo kan een tekort aan zink in bot leiden tot groeiproblemen en bij een zinktekort in de testes kan de puberteit verlaat optreden. Geringe zinktekorten schaden daarnaast het immuunsysteem, wat de ontwikkeling van allerlei klachten en aandoeningen in de hand kan werken [13]. Een lage zinkstatus wordt in verband gebracht met een verminderde weerstand en dus een verhoogd infectiegevaar.
Andere symptomen van een zinktekort zijn onder andere een trage wondgenezing en aften, kouwelijk en lusteloos, maagzuurproblemen, huidaandoeningen, witte vlekken en lijnen op de vingernagels, verminderde vruchtbaarheid, laag aantal zaadcellen, anorexia, verminderde schildklierfunctie, zwakke darmbarrière, haaruitval, ontstoken tong, oogleden en nagelbedden, depressies en (mentale) lethargie [57].
Ook wordt een zinktekort frequent in verband gebracht met een vermindering van zintuiglijke functies, waaronder het smaak- en reukvermogen [58]. Na virale infecties, waaronder COVID-19, hadden veel patiënten reuk- en smaakstoornissen, die vaak gepaard gingen met zinktekorten [59].
Bovenstaande verschijnselen zijn in zekere zin aspecifiek en kunnen ook samengaan met een of meerdere andere ziektebeelden [60–62]. Voorbeelden van ziektebeelden die vaak samengaan met een zinktekort zijn (virale) infecties, diabetes, depressie en astma [63].
Diagnostiek
De zinkstatus wordt doorgaans gemeten in het bloedplasma of serum [64]. Deze meting is echter niet altijd representatief voor de cellulaire zinkstatus en detecteert op individueel niveau alleen de ernstig zinktekorten. Een nauwkeurige beoordeling van de zinkstatus, vooral bij milde tot matige tekorten, is echter moeilijk omdat door regulatiemechanismen de zinkstatus vaak binnen de referentiewaarden valt. Ook haaranalyse, doorgaans een betrouwbare methode voor het meten van de mineraalstatus, is geen geschikte methode om de zinkstatus te meten.
Onderzoek naar meer betrouwbare biomarkers voor het bepalen van de zinkstatus is gaande [65]. Naast laboratoriumonderzoek is het zinvol om de klinische aspecten, waaronder risicofactoren, geografische prevalentie, leeftijd, samen met lichamelijk onderzoek en een passende anamnese af te nemen om een mogelijk zinktekort te bepalen [1].
Suppletie
Extra zink kan ingenomen worden om lichaamseigen niveaus aan te vullen. Zink komt voor in voedingssupplementen, zuigtabletten en in sommige vrij verkrijgbare zelfzorgproducten. Zink suppletie is mogelijk in verschillende vormen, zoals zinkzouten (bijvoorbeeld zinkoxide en zinksulfaat) en diverse soorten zinkchelaten.
Zinkzouten worden niet altijd goed opgenomen in het maagdarmkanaal, deels als gevolg van te weinig maagzuur of het gebruik van maagzuurremmers [66].
Bij zinkchelaten is zink gebonden aan organische zuren (zoals zinkcitraat, zinkorotaat en zinkpicolinaat) of aan aminozuren (zoals zinkmethionine en zinkbisglycinaat). Bij aminozuurgebonden mineralen concurreren mineralen in de voeding niet om opname.
Het percentage elementair zink, oftewel de hoeveelheid van het ‘pure’ mineraal, kan verschillen per supplement. Zo bevat zinksulfaat bijvoorbeeld 23% elementair zink en zinkgluconaat 14,3% elementair zink [57].
Zink wordt in de vorm van zinkmethionine beter opgenomen dan andere zinkpreparaten. De opname van zink wordt dan niet gehinderd door andere mineralen of voedingsfactoren als fytaten, oxalaten en tanninen, waardoor de biologische beschikbaarheid hoger is dan die van andere suppletievormen [67].
Toepassingen
Een goede zinkstatus is in elke levensfase erg belangrijk. Zinksuppletie kan uitkomst bieden in onderstaande situaties.
Ondersteuning maagzuurproductie en voedselvertering
Zink verbetert de maagzuursecretie, ondersteunt de activiteit van belangrijke spijsverteringsenzymen als pepsine en lipase, reguleert de pH-waarde van het maagsap en heeft een maagbeschermende werking [68]. Bij verstoringen van de normale fysiologie van het spijsverteringsstelsel is zinksuppletie zinvol.
Dit geldt voor mensen met uiteenlopende maagdarmaandoeningen [69], maar zink kan ook ondersteuning bieden aan mensen met een voedingspatroon rijk aan antinutriënten of medicatiegebruik als maagzuurremmers die een beroep doen op de maagzuurproductie en het maagdarmslijmvlies.
Ter ondersteuning van het immuunsysteem
Zink is essentieel voor een goed werkend immuunsysteem. Het lichaam verbruikt zink bij de afweer tegen (virale) infecties. Zo toont onderzoek een verhoogde biosynthese aan van metallothioneïnen die zink binden tijdens infecties [70]. Dit vermindert de toegang van vrij zink voor pathogenen, dat noodzakelijk is voor hun overleving. In ziektebeelden waar zinkdeficiëntie relatief vaak wordt gezien, zoals bij patiënten met een chronische infectie met het humaan papilloma virus (HPV), Hepatitis C virus (HCV) of het humaan immunodeficiëntie virus (HIV), kan het suppleren van zink gunstige effecten hebben [71].
Wetenschappelijk onderzoek heeft ook aangetoond dat patiënten met auto-immuunziekten vaak een zinktekort hebben [72]. Zo is zink bijvoorbeeld in staat Th17-lymfocyten te remmen die juist vatbaarheid voor auto-immuunziekten veroorzaken. Bij een zinktekort vervalt dit beschermende effect. Zinktekorten kunnen ook leiden tot een Th1/Th2 onbalans of beperkte differentiatie naar regulatoire T cellen (Tregs) die normaliter immuuntolerantie bevorderen en auto-immuunziekten helpen voorkomen [72]. Klinische studies naar het effect van zinksuppletie ter preventie of behandeling van auto-immuunziekten zijn echter schaars.
Verkoudheid
Zink blokkeert de binding en de vermenigvuldiging van het verkoudheidsvirus (rhinovirus) in het neusslijmvlies [70]. Hierbij wordt ook de lokale ontstekingsreactie onderdrukt. Zinksuppletie in de vorm van zuigtabletten of siroop verkort de duur van de verkoudheidssymptomen [73]. Uit een meta-analyse van zeven onderzoeken is gebleken dat de duur van verkoudheidssymptomen met 33% is afgenomen bij inname van zinkacetaat of zinkgluconaat tabletten (>75 mg/dag elementair zink) [74].
SARS-CoV-2 infecties en COVID-19
Bij de reguliere behandeling van SARS-CoV-2 infecties, ofwel COVID-19, wordt gebruik gemaakt van zogenaamde zink-ionoforen. Deze medicijnen remmen de replicatie van RNA-virussen door de concentratie zink in de cellen te verhogen. Ook natuurlijke zinkionoforen (zoals quercetine) hebben dit effect [75]. Zink speelt namelijk een belangrijke rol bij de eiwitsynthese, cellulaire proliferatie en apoptose. Eiwitsynthese is belangrijk voor de replicatie van de virale mantel en dus voor virale replicatie. Hoge cellulaire zinkconcentraties zijn in staat de (virale) eiwitsynthese te remmen [76]. Wetenschappelijk onderzoek toonde meer dan tien jaar geleden al aan dat de combinatie van een zink-ionofoor in combinatie met zink een krachtige remmer is van het eerste SARS-corona virus (SARS-CoV-1) [77].
Uit onderzoek bleek dat COVID-19 patiënten die tijdens verblijf in het ziekenhuis werden behandeld met zink, sneller uit het ziekenhuis werden ontslagen en minder vaak aan de beademing hoefden [78,79]. De patiënten werden behandeld met reguliere medicatie (zink-ionofoor) en gedurende 5 dagen tweemaal daags een hoge dosis zink (50 mg). De conditie van de interventiegroep verslechterde minder vaak waardoor er minder IC opnames waren en was er een lagere mortaliteit in vergelijking met de groep die geen zink gesuppleerd kreeg. Een vergelijkbaar effect werd gevonden in een andere studie. In totaal kregen 141 COVID-19 patiënten naast de reguliere behandeling zinksuppletie (50 mg dagelijks gedurende 5 dagen). De patiënten in de interventiegroep belanden minder vaak in het ziekenhuis en de sterftecijfers waren lager in vergelijking met de controlegroep [80].
Wondgenezing
Zink is nodig bij de instandhouding van de integriteit van huid- en slijmvliezen [81]. Zink speelt een rol in het stapsgewijze proces van wondgenezing (bloedstolling [coagulatie]), herstel van celmembranen, tegengaan van oxidatieve stress, lokale ontstekingen en vorming van littekenweefsel [4]. Onderzoek toont aan dat de ontoereikende wondheling bij patiënten met chronische zweren veroorzaakt kan worden door een verstoorde zinkstofwisseling en een verlaagd zinkgehalte in het bloed [82]. In een gerandomiseerd, dubbelblind onderzoek in 37 patiënten met beenulcera en lage zinkserumspiegels gaf plaatselijke behandeling met zinkoxide een betere wondgenezing, meer re-epithelialisatie, minder infecties en minder verslechtering van de zweren ten opzichte van de placebogroep [83]. Zinksuppletie (22 mg/dag gedurende 30 dagen) in de vorm van een combinatiepreparaat met arginine, proline, hoog vitamine A, C en E en selenium bleek effectiever dan placebo bij moeilijk te genezen wonden in de onderste ledematen in een gerandomiseerde studie [84].
Astma
Als antioxidant en ontstekingsremmer kan zink van belang zijn bij astma. In verschillende klinische studies worden zinktekorten geassocieerd met astma, astma-aanvallen en verminderd longvolume [85]. Vooral bij obese kinderen met een verhoogd risico op astma, werd een zinktekort in verband gebracht met een hogere incidentie van astma [86]. In een gerandomiseerde, placebo-gecontroleerde studie in kinderen met astma leidde suppletie met zink (50 mg/dag) tot een significante verbetering van klachten als hoesten, niezen, kortademigheid en longfunctie parameters [87]. Ook in een meer recente studie bij 50 kinderen bleek zink (1 mg/kg/dag) een effectief hulpmiddel bij het onder controle houden van nachtelijke symptomen van astma en het verbeteren van de longfunctie, zelfs als het aanvankelijke serumzinkniveau binnen het normale bereik lag [88]. Meer ondersteunende klinische studies zijn gewenst.
Darmgezondheid
Zink is van belang voor behoud van een gezonde slijmvlieslaag in het gehele maagdarmkanaal. Het versterkt onder meer de tight junctions tussen de darmepitheelcellen waardoor een goede barrièrefunctie gewaarborgd wordt [89]. Een zinktekort kan resulteren in een hyperpermeabele darm, waardoor ongewenste stoffen of pathogenen het lichaam binnendringen. Het wordt gerelateerd aan verschillende gastro-intestinale aandoeningen, zoals diarree, malabsorptie, coeliakie, inflammatoire darmziekten, maagzweren en gastro-oesofageale refluxziekte (GERD) [69]. Vooral bij jonge kinderen (<5 jaar) draagt een zinktekort substantieel bij aan morbiditeit en mortaliteit, vooral als gevolg van diarree [90].
Kinderen met acute diarree die worden behandeld met zink hebben een afname in de duur en snelheid van diarree, evenals een verminderde behoefte voor antibioticatherapie vergeleken met controles [91]. Verschillende systematische onderzoeken ondersteunen het gunstige effect van zinksuppletie op de duur, frequentie en ernst van acute en aanhoudende diarree [92,93]. In de zinkbehandelde groep werd echter vaker braken als bijwerking gerapporteerd. Ook bij infectieuze diarree, waarbij er vrijwel altijd sprake is van een verhoogde darmpermeabiliteit, heeft zinksuppletie verbetering laten zien [69].
Netvliesveroudering
Zink is van belang voor het gezichtsvermogen. Het komt in hoge concentraties voor in oogstructuren zoals de retina (netvlies) en choroidea (vaatvlies). Uit verschillende klinische onderzoeken blijkt dat zink de retinaal pigment epitheel (RPE) cellen kan beschermen tegen oxidatieve schade, wat een belangrijke factor is in de progressie van netvlies-veroudering, oftewel leeftijdsgebonden maculadegeneratie, (age-related macula degeneration, AMD) [94]. Een hoge inname van zink met andere antioxidanten als bètacaroteen, vitamine C en vitamine E leek het risico op AMD bij ouderen te verminderen [95]. Dit gunstige effect van zink in combinatie met koper en andere antioxidanten werd bevestigd door enkele andere grotere klinische studies [96–98]. Zinkoxide (80 mg/dag) bleek in staat netvliesdegeneratie te onderdrukken. Zink kan bovendien door de immuunreactie te verbeteren en ontstekingen te verminderen, de progressie van AMD helpen vertragen en de gezondheid van het netvlies verbeteren [99]. Mogelijk doet zink dit deels door autofagie (afbraak van beschadigde of onbruikbare celmaterialen) te bevorderen, wat vaak ondermaats is in AMD [99].
Koperstapeling
De ziekte van Wilson is een zeldzame, erfelijke stofwisselingsziekte die gekenmerkt wordt door de ophoping van koper in de lever en later in andere organen, zoals het zenuwstelsel, ogen, nieren en hart. Zink blokkeert de koperabsorptie en verhoogt de kopereliminatie in de ontlasting. Zinkacetaat wordt gebruikt bij de behandeling van patiënten met de ziekte van Wilson. Het kan effectief als monotherapie ingezet worden, zowel bij presymptomatische patiënten met de ziekte van Wilson als bij patiënten met neurologische of leversymptomen [100–102].
Acne
Mensen met acne vulgaris hebben een lager zinkgehalte in hun bloed. Klinische onderzoeken hebben laten zien dat zowel topicaal als oraal gebruik van zink effectief kan zijn bij de behandeling van acne. Een recente meta-analyse van 25 klinische studies liet een significante vermindering zien van acne papels na zinkbehandeling ten opzichte van placebo of andere actieve behandelingen [103]. Uit een gerandomiseerde klinische studie in 100 patiënten met milde tot matige acne, bleken de scores uit de Global Acne Grading System (GAGS) en Acne Quality of Life (AQoL) vragenlijsten significant beter na zinkbehandeling gedurende 12 weken (tablet zinksulfaat 400 mg/dag) in vergelijking met het antibioticum lymecycline (300 mg/dag) [104].
Acrodermatitis enteropathica
Acrodermatitis enteropathica is een zeldzame aangeboren aandoening als gevolg van mutaties in het zinktransporter gen SLC39A4 [105]. Het wordt vooral bij kinderen gezien. De darmen zijn onvoldoende in staat om zink op te nemen, waardoor zinktekorten ontstaan. Behandeling bestaat uit suppletie met zink, vaak levenslang, met 3 mg/kg/dag elementair zink. Zinksulfaat heeft wat betreft orale formulering de voorkeur. Bij adequate zinksuppletie is de prognose goed met een verwacht responspercentage van 100%. Onbehandelde acrodermatitis enteropathica is dodelijk in de eerste levensjaren.
ADHD
Zink is onder andere nauw betrokken bij de regulatie van de neurotransmitter dopamine, waar mensen met Attention Deficit Hyperactivity Disorder (ADHD) een tekort aan hebben. Ook een verlaagde zinkstatus wordt vaker gezien bij ADHD. Klinische onderzoeken laten zien dat inname van zink in combinatie met andere gangbare behandeling een lichte verbetering geeft van typische ADHD-symptomen zoals hyperactiviteit, impulsiviteit, en verminderde socialisatie [106–108]. Verschillende reviews en meta-analyses benadrukken het belang van zinkrijke voeding en zinksuppletie, maar meer en grotere klinische trials zijn gewenst [109,110].
Sikkelcelziekte
Een crosssectioneel onderzoek suggereert dat 44% van de kinderen met sikkelcelziekte een verlaagde plasmazinkconcentratie heeft [111], mogelijk als gevolg van een verhoogde behoefte of een slechte voedingsstatus [112]. Zinktekort treft ook ongeveer 60%-70% van de volwassenen met sikkelcelziekte [113]. Uit een meta-analyse bleek zinksuppletie de zinkstatus te verbeteren in sikkelcelpatiënten en het totaal aantal klinische infecties te verminderen [114]. Specifiek zinksulfaat bleek effectief in het verminderen van het aantal sikkelcelcrises.
Depressie
Zinktekort kan leiden tot depressie, verhoogde angst, prikkelbaarheid, emotionele instabiliteit en afwijkend sociaal gedrag. Uit klinische onderzoek blijkt dat depressieve patiënten een lager serumzinkgehalte hebben en dat een lage zinkinname kan bijdragen aan depressieve gevoelens [115–117]. Uit verschillende meta-analyses blijkt dat door de zinkinname te verhogen het risico op depressie verminderd kan worden [118,119].
Zwangerschap en foetale groei
Een ontoereikende zinkstatus tijdens de zwangerschap heeft negatieve effecten op de ontwikkeling van de foetus. Zinktekorten bij de moeder kunnen leiden tot groeivertraging, infecties, necrotiserende enterocolitis, dermatitis, chronische longziekten en retinopathie bij vroeggeborenen [120]. Een meta-analyse van 5 klinische onderzoeken bij te vroeg geboren kinderen suggereerde dat enterale zinksuppletie (10 mg/dag) de sterfte verminderde en de gewichtstoename verbeterde in vergelijking met placebo [121].
Lage maternale zinkniveaus worden ook in verband gebracht met zwangerschapscomplicaties zoals pre-eclampsie, zwangerschapsdiabetes, spontane vroeggeboorte en laag geboortegewicht [122]. Alhoewel de relatie tussen lage zinkniveaus en complicaties bij zowel moeder als kind bekend zijn, is er nog onvoldoende onomstotelijk bewijs voor het nut van zinksuppletie [123].
Mannelijke vruchtbaarheid
Zink is cruciaal voor het goed functioneren van het voortplantingssysteem bij de man, omdat de cellen die hiertoe behoren onderhevig zijn aan uitgebreide celdelings- en differentiatieprocessen die afhankelijk zijn van zink [124]. Mannen verliezen bovendien maar liefst 3 tot 4 mg zink per ejaculatie. Een tekort aan zink bij mannen kan resulteren in impotentie, hypogonadisme of een vertraagde seksuele ontwikkeling.
Onvruchtbaarheid wordt ook in verband gebracht met verlaagde zinkconcentraties in het bloed en zaadvocht [5]. Uit een meta-analyse van 20 klinische studies bleek dat zinksuppletie (zinksulfaat 66-220 mg/dag wat overeenkomt met ongeveer 15-50 mg/dag elementair zink per dag) het spermavolume, de beweeglijkheid van de zaadcellen en de kwaliteit van de zaadcellen verbeterde in onvruchtbare mannen [125].
PCOS
Verlaagde zinkspiegels worden frequent gezien bij vrouwen met het polycysteus ovarium syndroom (PCOS) en gaan gepaard met een verstoord hormonaal, lipiden- en glucosemetabolisme en verhoogde oxidatieve stress [124,126]. Uit een gerandomiseerd, placebogecontroleerd onderzoek in 65 vrouwen bleek suppletie met 220 mg zinksulfaat (dat is 50 mg zink/dag) gedurende 8 weken te leiden tot een verbetering van metabole parameters als insulineresistentie en lipidenprofiel ten opzichte van placebo [127]. Ook lijkt een gunstig effect te bestaan op klachten van alopecia en hirsutisme bij PCOS [128].
Een andere studie waarin zinksulfaat (50 mg zink/dag) werd gecombineerd met magnesiumoxide (250 mg/dag) gedurende 12 weken liet vooral gunstige effecten zien op pro-inflammatoire markers. Analyse van bloed van vrouwen uit de behandelde groep vertoonde een verlaging van hs-CRP en oxidatieve markers en bovendien een verminderde expressie van de inflammatoire markers IL-1 en TNFα [129]. Zinksuppletie lijkt gunstige effecten teweeg te brengen bij PCOS via verschillende werkingsmechanismen.
Dysmenorroe
Dysmenorroe, een pijnlijke menstruatie, vormt een substantieel probleem voor veel vrouwen in de vruchtbare leeftijd [124]. Bij primaire dysmenorroe, dat wordt gekenmerkt door baarmoederspasme in afwezigheid van pathologie, worden prostaglandinen en leukotriënen voor een groot deel verantwoordelijk gehouden voor de klachten. Vanwege zijn ontstekingsremmende en antioxidatieve werking en het verbeteren van de microcirculatie draagt zink mogelijk bij aan het verminderen van klachten in deze vrouwenpopulatie.
Uit verschillende studies blijkt dat zinksuppletie voorafgaand aan de menstruatie de intensiteit van de pijn die gepaard gaat met de menstruatie kan verminderen [124]. Zinksuppletie (variërend van één tot twee dagelijkse doses van 30-50 mg) gedurende 3-6 dagen voorafgaand of bij start van de menstruatie verlichtte de pijn tijdens de eerste cyclus, maar verlichtte de pijn significant meer tijdens de tweede of derde cyclus [130–133]. Een grotere pijnverlichting werd waargenomen wanneer zink (50 mg/dag) gelijktijdig werd gesuppleerd met mefenaminezuur (250 mg/dag) dan met alleen mefenaminezuur [134].
Premenstrueel syndroom
Vrouwen met het premenstrueel syndroom (PMS) hebben lagere serumzinkconcentraties [135,136]. Uit een gerandomiseerde klinische studie bij 142 vrouwen bleek dat de ernst van de PMS-klachten verminderde en de kwaliteit van leven toenam na zinksuppletie (zinksulfaat met 50 mg/dag elementair zink) ten opzichte van placebo [137]. Een recente gerandomiseerde studie onderschrijft het positieve effect van zink (30 mg zinkgluconaat/dag gedurende 12 weken) op zowel fysieke als psychologische symptomen en wijdde deze gunstige effecten mogelijk aan een stijging van de totale antioxidant capaciteit (TAC) en brain-derived neurotrophic factor (BDNF) [138].
Diabetes en metabole syndromen
Zink is betrokken bij de vorming, afgifte en opslag van insuline en is daarmee essentieel voor de glucosehomeostase in het lichaam [139]. Diabetespatiënten hebben een verlaagde zinkstatus, veelal door een verminderde absorptie en een verhoogde uitscheiding via de urine. Deze zinktekorten gaan vaak gepaard met een toename van oxidatieve stress, vooral in de insulineproducerende β-cellen van de pancreas. Deze verstoringen werken insulineresistentie in de hand, waardoor uiteindelijk problemen in perifere weefsel en diabetescomplicaties ontstaan.
Onderzoeken hebben aangetoond dat door zinkniveaus te herstellen, het glucosetransport in cellen en weefsel verbetert [140,141]. Zinksuppletie verlaagt onder andere het bloedglucosegehalte in nuchtere toestand, geglyceerd hemoglobine (HbA1c) en de ontstekingsmarker C-reactief eiwit (CRP) bij diabetes type II patiënten [142]. Een meta-analyse van 14 gerandomiseerde onderzoeken bij diabetes type II patiënten liet bovendien zien dat na inname van zink de waarden voor triglyceriden, totaal cholesterol en lage dichtheid lipoproteïne (LDL) significant daalden ten opzichte van placebo [143]. De hoge dichtheid lipoproteïne (HDL) waarde steeg significant na zinksuppletie.
Een vergelijkbaar effect werd gezien bij patiënten met een coronaire hartziekte [144]. Ook daar verbeterde zink (150 mg/dag zinksulfaat plus 250 mg/dag magnesiumoxide gedurende 12 weken) het bloedglucose, de lipidenwaarden, CRP en totale antioxidant capaciteit. In een andere studie leidde zinksuppletie bij type II diabetespatiënten tot normalisering van een specifieke biomarker voor oxidatieve DNA-schade (8-hydroxy-2-deoxyguanosine), minder DNA schade dus [145].
Ook in diabetes type I patiënten, een auto-immuun aandoening waarbij de pancreas geen insuline meer produceert, is zinksuppletie effectief in het verbeteren van bloedglucosewaarden [139]. Obesitas en metabool syndroom, bekende voorlopers van diabetes zijn gebaat bij zinkhomeostase [14].
Contra-indicaties
Voorzichtigheid en oplettendheid is geboden bij mensen met een bestaande koperdeficiëntie of risicofactoren voor koperdeficiëntie zoals de ziekte van Menkes, gastro-intestinale chirurgie, bariatrische chirurgie of malabsorptie ziekten [57].
Overleg met een deskundig therapeut of arts is raadzaam.
Dosering
De aanbevolen dagelijkse hoeveelheid (ADH) is door de Gezondheidsraad vastgesteld op 9 mg/dag voor mannen en 7 mg/dag voor vrouwen, en komt voort uit de Nordic Nutrition Recommendations uit 2012 [146]. Gedurende de zwangerschap is het advies 9,1 mg/dag zink te nemen [35]. Het advies is om te streven naar een minimale dagelijkse zinkinname van 15-20 mg (uit voeding en suppletie). Er zijn echter allerlei factoren die de zinkbehoefte kunnen verhogen, waardoor suppletie wenselijk kan zijn.
Een orthomoleculaire onderhoudsdosering bedraagt ongeveer 15-25 mg elementair zink per dag. Een verstoring van het calcium- en kopermetabolisme wordt bij een onderhoudsdosering niet verwacht.
Therapeutische doseringen
Therapeutische doseringen voor zink liggen hoger, tussen de 15-50 mg elementair zink per dag. Klinische interventiestudies gaan meestal ook niet hoger dan een dosis van 50 mg/dag elementair zink. Suppleer altijd een organisch gebonden vorm van zink zoals zinkmethionine, vanwege de betere biologische beschikbaarheid. Houdt bij hogere doses altijd de koperwaarden in de gaten; er bestaat een relatief risico op een tekort aan koper. Een kopersupplement is dan eventueel gewenst.
Bij langdurige suppletie is bovendien het advies om zink te suppleren in combinatie met koper, ijzer en mangaan.
Veiligheid
Het is niet aannemelijk dat er uit voeding toxische hoeveelheden zink kunnen worden gehaald. Suppletie van zink in hoge doseringen kan wel leiden tot ongewenste effecten, zoals metaalsmaak, braakneigingen en maagklachten. Overmatige inname van zink kan de absorptie van ijzer en koper verstoren en mogelijk tekorten aan deze essentiële mineralen verergeren.
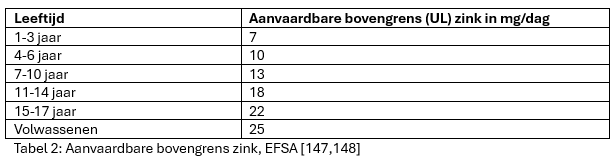
De EFSA heeft daarom een aanvaardbare bovengrens (Tolerable Upper Intake Level, UL) vastgesteld voor verschillende leeftijden (zie Tabel 2) [147,148]. De grootste concentratie waarbij geen waarneembare schadelijke effecten optreden (No Observed Adverse Effect Level, NOAEL) van zink is vastgesteld op 50 mg/dag. Zinksuppletie boven de 50 mg/dag wordt in verband gebracht met een kopertekort.
Acute zinktoxiciteit is zeldzaam. Acute schadelijke effecten van een te hoge zinkinname zijn onder andere misselijkheid, braken, buikpijn, buikkrampen, diarree en hoofdpijn [147]. Langdurige zinkinname boven de bovengrens (tussen de 50 en 300 mg/dag) verhogen het risico op schadelijke gezondheidseffecten. Symptomen kunnen onder meer zijn leucopenie, neutropenie, anemie, verminderde immuunfunctie, verlaagde koperwaarden en als gevolg van verminderde activiteit van onder andere SOD in zijn rol als antioxidant [147].
Bijwerkingen
Over het algemeen wordt orale suppletie van zink in doseringen onder de aanvaardbare bovengrens goed verdragen [57]. Topicaal wordt zink goed verdragen. In hogere orale doseringen (>50 mg/dag) kunnen klachten optreden als buikkrampen, diarree, misselijkheid, braken, metaalsmaak, droge mond, hoofdpijn en een verminderde reuk. Zeldzame ernstige bijwerkingen die zijn gemeld na een overdosis zink zijn acute niertubulaire necrose, interstitiële nefritis, neurologische complicaties, ernstig braken en sideroblastische anemie.
Interacties
Zink kan interacties aan gaan met andere stoffen en geneesmiddelen, waardoor de zinkstatus of de werkzaamheid van de stof of het geneesmiddel beïnvloed wordt.
De volgende mineralen en vitaminen hebben een wisselwerking met zink [57,149].
- Koper. Zink en koper gaan een competitie met elkaar aan en kunnen elkaars opname verminderen, omdat ze gebruikmaken van dezelfde transportmechanismen in de dunne darm. Langdurige zinkinname (wekenlang in doseringen van >50 mg/dag) vermindert de koperabsorptie, waardoor soms een kopertekort en bloedarmoede kan ontstaan. Houd daarmee rekening bij gelijktijdig gebruik van supplementen in hoge dosering. De aanwezigheid van koper en zink in voeding beïnvloeden elkaar niet.
- IJzer. Ook zink en ijzer gaan een competitie met elkaar aan en kunnen elkaars opname verminderen. Houd daarmee rekening bij gelijktijdig gebruik van supplementen in hoge dosering. De aanwezigheid van ijzer en zink in voeding beïnvloeden elkaar niet
- Calcium. Calcium remt mogelijk de zinkabsorptie.
- Chroom. Zink en chroom kunnen elkaars opname verminderen.
- Magnesium. Zink en magnesium kunnen elkaars opname verminderen.
- Mangaan. Zink verhoogt mogelijk de absorptie van mangaan.
- Bromelaïne. Zink vermindert mogelijk de effecten van bromelaïne.
- Bètacaroteen. Zink vermindert mogelijk de bètacaroteenwaarden.
- EDTA. EDTA (een chelaatvormer) kan de zinkuitscheiding verhogen en het zinkgehalte verlagen.
- Foliumzuur. Foliumzuur vermindert de zinkabsorptie.
- Vitamine A. Zink beïnvloedt de biologische beschikbaarheid van vitamine A. Een tekort geeft minder opname van vitamine A en een verminderde vrijmaking uit de lever.
- Vitamine D. Vitamine D kan mogelijk de absorptie van zink veranderen.
Onderstaande geneesmiddelen kunnen beïnvloed worden door de zinkstatus of hebben zelf invloed op de zinkstofwisseling:
- Antibiotica. Fluorchinolonen (zoals ciprofloxacine), tetracyclinen en cefalexine (behoort tot de groep van de cefalosporines) gaan in het maagdarmkanaal een interactie aan met zink waardoor de opname van zowel zink als het antibioticum worden geremd [57,150,151]. Neem zinksupplementen en antibiotica daarom minimaal 2 uur van elkaar gescheiden in.
- Penicillamine. Zink en penicillamine kunnen een interactie met elkaar aangaan en elkaars werking verminderen. Zink kan de opname en werking van penicillamine verminderen. Penicillamine wordt onder andere ingezet bij de behandeling van de ziekte van Wilson.
- Integrase remmers. Theoretisch gezien kan zink de opname en werking van deze antivirale medicijnen remmen. Wees voorzichtig met deze combinatie
- Ritonavir. Dit antiviraal middel (HIV-proteaseremmer) kan geremd worden door zink in het maagdarmkanaal waardoor er minder absorptie is.
- Diuretica. Het gebruik van thiazidediuretica kan de zinkuitscheiding verhogen en het zinkgehalte verlagen
- Deferoxamine. Dit medicijn bindt ijzer en aluminium en wordt onder meer ingezet bij ijzerstapelingsziekte. Het kan de zinkuitscheiding verhogen en het zinkgehalte verlagen.
- Propofol, een kortwerkend intraveneus anestheticum. Het kan de zinkuitscheiding verhogen en het zinkgehalte verlagen.
- Antidiabetica. Omdat extra zink de bloedglucosespiegel kan verlagen, wordt mensen die antidiabetica gebruiken aangeraden om zinksupplementen met voorzichtigheid te gebruiken.
- ACE-remmers. ACE-remmers, met name captopril, kunnen de zinkstatus verlagen [66].
- Orale anticonceptiva. Vrouwen die de anticonceptiepil slikken, hebben mogelijk een verhoogde zinkbehoefte [152].
Synergisme en ondersteunende stoffen
Zink werkt nauw samen met andere mineralen en stoffen om verschillende lichaamsprocessen te ondersteunen. Bovendien komt een zinktekort vrijwel nooit alleen voor; vaak zijn er meerdere mineralen- of nutriëntentekorten aanwezig. Hieronder worden enkele voorbeelden genoemd van stoffen waarmee zink samenwerkt.
Selenium & Vitamine D
Voldoende voorraad van zink, selenium en vitamine D is essentieel voor het ondersteunen van het immuunsysteem, de weerstand tegen virale infecties en het verminderen van ontstekingen. Zo bleek recentelijk dat een goede zink-, selenium- en vitamine D-status bescherming zou kunnen bieden tegen SARS-CoV-2 infecties en de ernst van symptomen zou kunnen verlichten [153].
Koper, ijzer & mangaan
Zink maakt onderdeel uit van het antioxidatieve enzym SOD. Naast zink bevat het SOD-enzym in het cytosol ook koper. Het enzym is alleen functioneel als beide mineralen aanwezig zijn. In het SOD-enzym dat voorkomt in de mitochondriën komt bovendien mangaan voor naast zink. SOD zet vrije zuurstofradicalen om in waterstofperoxide, dat vervolgens door catalase omgezet wordt in water en zuurstof. Catalase heeft naast zink ook als cofactor het mineraal ijzer nodig [9]. Het is duidelijk dat enige balans tussen deze mineralen belangrijk is. Het advies is daarom om bij langdurige suppletie altijd de mineralen ijzer, zink, mangaan en koper samen in te nemen.
IJzer & vitamine A
Zink en ijzer zijn de twee meest voorkomende mineralen in ons lichaam. In de voeding komen zink en ijzer in dezelfde voedingsmiddelen voor; een tekort aan het ene mineraal betekent al snel ook een tekort aan het andere mineraal. IJzer kunnen we echter opslaan in ons lichaam, zink niet. Zowel zinktekorten als ijzertekorten komen veel voor.
Anemie ten gevolge van een ijzertekort is een veelvoorkomend probleem onder premenopauzale vrouwen, sommige baby’s en kinderen en vegetariërs. IJzersuppletie, meer dan 25 mg ter verbetering van de ijzerstatus, vermindert ongewenst de opname van zink. Echter, ijzertekorten kunnen wel eens het gevolg zijn van onderliggende zinktekorten [154]. Zink kan namelijk het ijzermetabolisme reguleren via stimulatie van absorptie en herverdeling in de weefsels [31]. Bij een ijzertekort kan extra zink, naast extra ijzer, zorgen voor een betere ijzeropname in de darm. Wanneer extra ijzer ingezet moet worden, wordt aangeraden dit verspreid over de dag in te nemen en niet samen met zink.
Daarnaast speelt ook vitamine A een belangrijke rol omdat het onder andere de absorptie verhoogt van zowel zink als ijzer [154].
Referenties
[1] Maxfield L, Shukla S, Crane JS. Zinc Deficiency. StatPearls, Treasure Island (FL): StatPearls Publishing; 2024.
[2] Stiles LI, Ferrao K, Mehta KJ. Role of zinc in health and disease. Clin Exp Med 2024;24:38. https://doi.org/10.1007/s10238-024-01302-6.
[3] Knez M, Stangoulis JCR, Glibetic M, Tako E. The Linoleic Acid: Dihomo-γ-Linolenic Acid Ratio (LA:DGLA)-An Emerging Biomarker of Zn Status. Nutrients 2017;9:825. https://doi.org/10.3390/nu9080825.
[4] Lin P-H, Sermersheim M, Li H, Lee PHU, Steinberg SM, Ma J. Zinc in Wound Healing Modulation. Nutrients 2017;10. https://doi.org/10.3390/nu10010016.
[5] Fallah A, Mohammad-Hasani A, Colagar AH. Zinc is an Essential Element for Male Fertility: A Review of Zn Roles in Men’s Health, Germination, Sperm Quality, and Fertilization. J Reprod Infertil 2018;19:69–81.
[6] Skalny AV, Aschner M, Tinkov AA. Zinc. Adv Food Nutr Res 2021;96:251–310. https://doi.org/10.1016/bs.afnr.2021.01.003.
[7] Cassandri M, Smirnov A, Novelli F, Pitolli C, Agostini M, Malewicz M, et al. Zinc-finger proteins in health and disease. Cell Death Discov 2017;3:17071. https://doi.org/10.1038/cddiscovery.2017.71.
[8] Ho E. Zinc deficiency, DNA damage and cancer risk. J Nutr Biochem 2004;15:572–8. https://doi.org/10.1016/j.jnutbio.2004.07.005.
[9] Mcdowell L, Wilkinson N, Madison R, Felix T. Vitamins and minerals functioning as antioxidants with supplementation considerations 2007.
[10] Jarosz M, Olbert M, Wyszogrodzka G, Młyniec K, Librowski T. Antioxidant and anti-inflammatory effects of zinc. Zinc-dependent NF-κB signaling. Inflammopharmacology 2017;25:11–24. https://doi.org/10.1007/s10787-017-0309-4.
[11] Altobelli GG, Van Noorden S, Balato A, Cimini V. Copper/Zinc Superoxide Dismutase in Human Skin: Current Knowledge. Front Med (Lausanne) 2020;7:183. https://doi.org/10.3389/fmed.2020.00183.
[12] Grzywacz A, Gdula-Argasińska J, Muszyńska B, Tyszka-Czochara M, Librowski T, Opoka W. Metal responsive transcription factor 1 (MTF-1) regulates zinc dependent cellular processes at the molecular level. Acta Biochim Pol 2015;62:491–8. https://doi.org/10.18388/abp.2015_1038.
[13] Wessels I, Maywald M, Rink L. Zinc as a Gatekeeper of Immune Function. Nutrients 2017;9:1286. https://doi.org/10.3390/nu9121286.
[14] Fukunaka A, Fujitani Y. Role of Zinc Homeostasis in the Pathogenesis of Diabetes and Obesity. Int J Mol Sci 2018;19:476. https://doi.org/10.3390/ijms19020476.
[15] Severo JS, Morais JBS, de Freitas TEC, Andrade ALP, Feitosa MM, Fontenelle LC, et al. The Role of Zinc in Thyroid Hormones Metabolism. Int J Vitam Nutr Res 2019;89:80–8. https://doi.org/10.1024/0300-9831/a000262.
[16] Gower-Winter SD, Levenson CW. Zinc in the central nervous system: From molecules to behavior. Biofactors 2012;38:186–93. https://doi.org/10.1002/biof.1012.
[17] Cull-Candy S, Brickley S, Farrant M. NMDA receptor subunits: diversity, development and disease. Current Opinion in Neurobiology 2001;11:327–35. https://doi.org/10.1016/S0959-4388(00)00215-4.
[18] Fawcett WJ, Haxby EJ, Male DA. Magnesium: physiology and pharmacology. Br J Anaesth 1999;83:302–20. https://doi.org/10.1093/bja/83.2.302.
[19] Schramel P, Lill G, Hasse S, Klose BJ. Mineral- and trace element concentrations in human breast milk, placenta, maternal blood, and the blood of the newborn. Biol Trace Elem Res 1988;16:67–75. https://doi.org/10.1007/BF02795335.
[20] Institute of Medicine (U. S.). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington (DC): The National Academies Press; 2001.
[21] Wise A. Phytate and zinc bioavailability. International Journal of Food Sciences and Nutrition 1995;46:53–63. https://doi.org/10.3109/09637489509003386.
[22] Sandström B. Bioavailability of zinc. Eur J Clin Nutr 1997;51 Suppl 1:S17-19.
[23] Krebs NF. Overview of zinc absorption and excretion in the human gastrointestinal tract. The Journal of Nutrition 2000;130:1374S-7S.
[24] Maares M, Haase H. A Guide to Human Zinc Absorption: General Overview and Recent Advances of In Vitro Intestinal Models. Nutrients 2020;12:762. https://doi.org/10.3390/nu12030762.
[25] Hahn CJ, Evans GW. Absorption of trace metals in the zinc-deficient rat. Am J Physiol 1975;228:1020–3. https://doi.org/10.1152/ajplegacy.1975.228.4.1020.
[26] O’Brien KO, Zavaleta N, Caulfield LE, Wen J, Abrams SA. Prenatal iron supplements impair zinc absorption in pregnant Peruvian women. J Nutr 2000;130:2251–5. https://doi.org/10.1093/jn/130.9.2251.
[27] Takagishi T, Hara T, Fukada T. Recent Advances in the Role of SLC39A/ZIP Zinc Transporters In Vivo. Int J Mol Sci 2017;18. https://doi.org/10.3390/ijms18122708.
[28] Fukada T, Yamasaki S, Nishida K, Murakami M, Hirano T. Zinc homeostasis and signaling in health and diseases. J Biol Inorg Chem 2011;16:1123–34. https://doi.org/10.1007/s00775-011-0797-4.
[29] Bafaro E, Liu Y, Xu Y, Dempski RE. The emerging role of zinc transporters in cellular homeostasis and cancer. Signal Transduct Target Ther 2017;2:17029-. https://doi.org/10.1038/sigtrans.2017.29.
[30] King JC, Shames DM, Woodhouse LR. Zinc homeostasis in humans. The Journal of Nutrition 2000;130:1360S-1366S. https://doi.org/10.1093/jn/130.5.1360S.
[31] Kondaiah P, Yaduvanshi PS, Sharp PA, Pullakhandam R. Iron and Zinc Homeostasis and Interactions: Does Enteric Zinc Excretion Cross-Talk with Intestinal Iron Absorption? Nutrients 2019;11:E1885. https://doi.org/10.3390/nu11081885.
[32] Hara T, Takeda T-A, Takagishi T, Fukue K, Kambe T, Fukada T. Physiological roles of zinc transporters: molecular and genetic importance in zinc homeostasis. J Physiol Sci 2017;67:283–301. https://doi.org/10.1007/s12576-017-0521-4.
[33] Nriagu J. Zinc toxicity in humans 2019.
[34] Nordic Nutrition Recommendations. Nordic Nutrition Recommendations 2012 2014. https://doi.org/10.6027/Nord2014-002.
[35] Gezondheidsraad (2021). Voedingsnormen voor vitamines en mineralen voor zwangere vrouwen - Advies - Gezondheidsraad 2021. https://www.gezondheidsraad.nl/documenten/adviezen/2021/06/22/voedingsnormen-voor-vitamines-en-mineralen-voor-zwangere-vrouwen (accessed September 16, 2024).
[36] RIVM. Voedselconsumptiepeiling 2019-2021 | Inname van zink | Wat eet Nederland n.d. https://www.wateetnederland.nl/resultaten/mineralen/zink (accessed October 14, 2024).
[37] EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). Scientific Opinion on Dietary Reference Values for zinc. EFSA Journal 2014;12:3844. https://doi.org/10.2903/j.efsa.2014.3844.
[38] Richter P, Faroon O, Pappas RS. Cadmium and Cadmium/Zinc Ratios and Tobacco-Related Morbidities. Int J Environ Res Public Health 2017;14:1154. https://doi.org/10.3390/ijerph14101154.
[39] McClain CJ, Su LC. Zinc deficiency in the alcoholic: a review. Alcohol Clin Exp Res 1983;7:5–10. https://doi.org/10.1111/j.1530-0277.1983.tb05402.x.
[40] Skalny AV, Skalnaya MG, Grabeklis AR, Skalnaya AA, Tinkov AA. Zinc deficiency as a mediator of toxic effects of alcohol abuse. Eur J Nutr 2018;57:2313–22. https://doi.org/10.1007/s00394-017-1584-y.
[41] Prasad AS. Clinical, endocrinological and biochemical effects of zinc deficiency. Clin Endocrinol Metab 1985;14:567–89. https://doi.org/10.1016/s0300-595x(85)80007-4.
[42] Menzano E, Carlen PL. Zinc Deficiency and Corticosteroids in the Pathogenesis of Alcoholic Brain Dysfunction—A Review. Alcoholism: Clinical and Experimental Research 1994;18:895–901. https://doi.org/10.1111/j.1530-0277.1994.tb00057.x.
[43] Navarro S, Valderrama R, To-Figueras J, Giménez A, López JM, Campo E, et al. Role of zinc in the process of pancreatic fibrosis in chronic alcoholic pancreatitis. Pancreas 1994;9:270–4. https://doi.org/10.1097/00006676-199403000-00020.
[44] Craig WJ. Nutrition Concerns and Health Effects of Vegetarian Diets. Nutrition in Clinical Practice 2010;25:613–20. https://doi.org/10.1177/0884533610385707.
[45] European Food Safety Authority. Tolerable upper intake levels for vitamins and minerals. European Food Safety Authority; 2007.
[46] Madej D, Borowska K, Bylinowska J, Szybalska A, Pietruszka B. Dietary intakes of iron and zinc assessed in a selected group of the elderly: are they adequate? Rocz Panstw Zakl Hig 2013;64:97–104.
[47] Marcellini F, Giuli C, Papa R, Gagliardi C, Dedoussis G, Herbein G, et al. Zinc status, psychological and nutritional assessment in old people recruited in five European countries: Zincage study. Biogerontology 2006;7:339–45. https://doi.org/10.1007/s10522-006-9048-4.
[48] Caulfield LE, Zavaleta N, Shankar AH, Merialdi M. Potential contribution of maternal zinc supplementation during pregnancy to maternal and child survival. The American Journal of Clinical Nutrition 1998;68:499S-508S. https://doi.org/10.1093/ajcn/68.2.499S.
[49] Krebs NF. Zinc supplementation during lactation. The American Journal of Clinical Nutrition 1998;68:509S-512S. https://doi.org/10.1093/ajcn/68.2.509S.
[50] Hambidge KM, Krebs NF. Zinc Deficiency: A Special Challenge. The Journal of Nutrition 2007;137:1101–5. https://doi.org/10.1093/jn/137.4.1101.
[51] Prasad AS. Zinc deficiency. BMJ 2003;326:409–10.
[52] Brown KH, Peerson JM, Allen LH. Effect of zinc supplementation on children’s growth: a meta-analysis of intervention trials. Bibl Nutr Dieta 1998:76–83. https://doi.org/10.1159/000059448.
[53] Naber TH, van den Hamer CJ, Baadenhuysen H, Jansen JB. The value of methods to determine zinc deficiency in patients with Crohn’s disease. Scand J Gastroenterol 1998;33:514–23. https://doi.org/10.1080/00365529850172098.
[54] Valberg LS, Flanagan PR, Kertesz A, Bondy DC. Zinc absorption in inflammatory bowel disease. Dig Dis Sci 1986;31:724–31. https://doi.org/10.1007/BF01296450.
[55] Prasad AS. Zinc deficiency: its characterization and treatment. Met Ions Biol Syst 2004;41:103–37.
[56] Vreugdenhil M, Akkermans MD, van der Merwe LF, van Elburg RM, van Goudoever JB, Brus F. Prevalence of Zinc Deficiency in Healthy 1-3-Year-Old Children from Three Western European Countries. Nutrients 2021;13:3713. https://doi.org/10.3390/nu13113713.
[57] NatMed Pro - Professional Monograph - Zinc n.d. https://naturalmedicines.therapeuticresearch.com/databases/food,-herbs-supplements/professional.aspx?productid=982#adverseEvents (accessed September 17, 2024).
[58] Pisano M, Hilas O. Zinc and Taste Disturbances in Older Adults: A Review of the Literature. Consult Pharm 2016;31:267–70. https://doi.org/10.4140/TCP.n.2016.267.
[59] Tsuchiya H. Gustatory and Saliva Secretory Dysfunctions in COVID-19 Patients with Zinc Deficiency. Life (Basel) 2022;12:353. https://doi.org/10.3390/life12030353.
[60] Maret W, Sandstead HH. Zinc requirements and the risks and benefits of zinc supplementation. J Trace Elem Med Biol 2006;20:3–18. https://doi.org/10.1016/j.jtemb.2006.01.006.
[61] Haase H, Rink L. Functional significance of zinc-related signaling pathways in immune cells. Annu Rev Nutr 2009;29:133–52. https://doi.org/10.1146/annurev-nutr-080508-141119.
[62] Clark ML, Kumar P. Kumar and Clark’s Clinical Medicine. 2017.
[63] Chasapis CT, Loutsidou AC, Spiliopoulou CA, Stefanidou ME. Zinc and human health: an update. Arch Toxicol 2012;86:521–34. https://doi.org/10.1007/s00204-011-0775-1.
[64] Wieringa FT, Dijkhuizen MA, Fiorentino M, Laillou A, Berger J. Determination of zinc status in humans: which indicator should we use? Nutrients 2015;7:3252–63. https://doi.org/10.3390/nu7053252.
[65] Cheng J, Bar H, Tako E. Zinc Status Index (ZSI) for Quantification of Zinc Physiological Status. Nutrients 2021;13:3399. https://doi.org/10.3390/nu13103399.
[66] Mohn ES, Kern HJ, Saltzman E, Mitmesser SH, McKay DL. Evidence of Drug-Nutrient Interactions with Chronic Use of Commonly Prescribed Medications: An Update. Pharmaceutics 2018;10. https://doi.org/10.3390/pharmaceutics10010036.
[67] Chien XX, Zafra-Stone S, Bagchi M, Bagchi D. Bioavailability, antioxidant and immune-enhancing properties of zinc methionine. Biofactors 2006;27:231–44.
[68] Duggan C, Gannon J, Walker WA. Protective nutrients and functional foods for the gastrointestinal tract123. The American Journal of Clinical Nutrition 2002;75:789–808. https://doi.org/10.1093/ajcn/75.5.789.
[69] Chao H-C. Zinc Deficiency and Therapeutic Value of Zinc Supplementation in Pediatric Gastrointestinal Diseases. Nutrients 2023;15:4093. https://doi.org/10.3390/nu15194093.
[70] Subramanian Vignesh K, Deepe Jr. G. Metallothioneins: Emerging Modulators in Immunity and Infection. IJMS 2017;18:2197. https://doi.org/10.3390/ijms18102197.
[71] Read SA, Obeid S, Ahlenstiel C, Ahlenstiel G. The role of zinc in antiviral immunity. Adv Nutr 2019;10:696–710. https://doi.org/10.1093/advances/nmz013.
[72] Sanna A, Firinu D, Zavattari P, Valera P. Zinc Status and Autoimmunity: A Systematic Review and Meta-Analysis. Nutrients 2018;10. https://doi.org/10.3390/nu10010068.
[73] Science M, Johnstone J, Roth DE, Guyatt G, Loeb M. Zinc for the treatment of the common cold: a systematic review and meta-analysis of randomized controlled trials. CMAJ : Canadian Medical Association Journal = Journal de l’Association Medicale Canadienne 2012. https://doi.org/10.1503/cmaj.111990.
[74] Hemilä H. Zinc lozenges and the common cold: a meta-analysis comparing zinc acetate and zinc gluconate, and the role of zinc dosage. JRSM Open 2017;8:2054270417694291. https://doi.org/10.1177/2054270417694291.
[75] Grudlewska-Buda K, Wiktorczyk-Kapischke N, Budzyńska A, Kwiecińska-Piróg J, Przekwas J, Kijewska A, et al. The Variable Nature of Vitamin C—Does It Help When Dealing with Coronavirus? Antioxidants 2022;11:1247. https://doi.org/10.3390/antiox11071247.
[76] Pal A, Squitti R, Picozza M, Pawar A, Rongioletti M, Dutta AK, et al. Zinc and COVID-19: Basis of Current Clinical Trials. Biol Trace Elem Res 2020:1–11. https://doi.org/10.1007/s12011-020-02437-9.
[77] te Velthuis AJW, van den Worm SHE, Sims AC, Baric RS, Snijder EJ, van Hemert MJ. Zinc inhibits coronavirus and arterivirus RNA polymerase activity in vitro and zinc ionophores block the replication of these viruses in cell culture. PLoS Pathog 2010;6:e1001176. https://doi.org/10.1371/journal.ppat.1001176.
[78] Carlucci PM, Ahuja T, Petrilli C, Rajagopalan H, Jones S, Rahimian J. Zinc sulfate in combination with a zinc ionophore may improve outcomes in hospitalized COVID-19 patients. J Med Microbiol 2020;69:1228–34. https://doi.org/10.1099/jmm.0.001250.
[79] Carlucci P, Ahuja T, Petrilli C, Rajagopalan H, Jones S, Rahimian J. Hydroxychloroquine and azithromycin plus zinc vs hydroxychloroquine and azithromycin alone: outcomes in hospitalized COVID-19 patients. 2020. https://doi.org/10.1101/2020.05.02.20080036.
[80] Derwand R, Scholz M, Zelenko V. COVID-19 outpatients: early risk-stratified treatment with zinc plus low-dose hydroxychloroquine and azithromycin: a retrospective case series study. International Journal of Antimicrobial Agents 2020;56:106214. https://doi.org/10.1016/j.ijantimicag.2020.106214.
[81] Wintergerst ES, Maggini S, Hornig DH. Contribution of selected vitamins and trace elements to immune function. Ann Nutr Metab 2007;51:301–23. https://doi.org/10.1159/000107673.
[82] Lansdown ABG, Mirastschijski U, Stubbs N, Scanlon E, Agren MS. Zinc in wound healing: theoretical, experimental, and clinical aspects. Wound Repair Regen 2007;15:2–16. https://doi.org/10.1111/j.1524-475X.2006.00179.x.
[83] Ågren MS, Phothong N, Burian EA, Mogensen M, Hædersdal M, Jorgensen LN. Topical Zinc Oxide Assessed in Two Human Wound-healing Models. Acta Derm Venereol 2021;101:adv00465. https://doi.org/10.2340/00015555-3829.
[84] Mehl AA, Damião AO, Viana SD, Andretta CP. Hard-to-heal wounds: a randomised trial of an oral proline-containing supplement to aid repair. J Wound Care 2021;30:26–31. https://doi.org/10.12968/jowc.2021.30.1.26.
[85] Maywald M, Rink L. Zinc Deficiency and Zinc Supplementation in Allergic Diseases. Biomolecules 2024;14:863. https://doi.org/10.3390/biom14070863.
[86] Cheng C, Lin J, Zhang Z, Zhang L. Association between dietary zinc intake and asthma in overweight or obese children and adolescents: A cross-sectional analysis of NHANES. World Allergy Organ J 2024;17:100900. https://doi.org/10.1016/j.waojou.2024.100900.
[87] Ghaffari J, Khalilian A, Salehifar E, Khorasani E, Rezaii MS. Effect of zinc supplementation in children with asthma: a randomized, placebo-controlled trial in northern Islamic Republic of Iran. East Mediterr Health J 2014;20:391–6.
[88] Abdelaziz I, Kotb M, Yassin N, Rabie W, Alsayed A, Hamed D. Zinc Supplementation Improves Nocturnal Asthma Symptoms. Pediatric Sciences Journal 2022;2:10–6. https://doi.org/10.21608/cupsj.2021.107314.1038.
[89] Skrovanek S, DiGuilio K, Bailey R, Huntington W, Urbas R, Mayilvaganan B, et al. Zinc and gastrointestinal disease. World J Gastrointest Pathophysiol 2014;5:496–513. https://doi.org/10.4291/wjgp.v5.i4.496.
[90] Fischer Walker CL, Ezzati M, Black RE. Global and regional child mortality and burden of disease attributable to zinc deficiency. Eur J Clin Nutr 2009;63:591–7. https://doi.org/10.1038/ejcn.2008.9.
[91] Walker CLF, Black RE. Zinc for the treatment of diarrhoea: effect on diarrhoea morbidity, mortality and incidence of future episodes. Int J Epidemiol 2010;39 Suppl 1:i63-69. https://doi.org/10.1093/ije/dyq023.
[92] Patel A, Mamtani M, Dibley MJ, Badhoniya N, Kulkarni H. Therapeutic value of zinc supplementation in acute and persistent diarrhea: a systematic review. PLoS ONE 2010;5:e10386. https://doi.org/10.1371/journal.pone.0010386.
[93] Lukacik M, Thomas RL, Aranda JV. A meta-analysis of the effects of oral zinc in the treatment of acute and persistent diarrhea. Pediatrics 2008;121:326–36. https://doi.org/10.1542/peds.2007-0921.
[94] Rajapakse D, Curtis T, Chen M, Xu H. Zinc Protects Oxidative Stress-Induced RPE Death by Reducing Mitochondrial Damage and Preventing Lysosome Rupture. Oxid Med Cell Longev 2017;2017:6926485. https://doi.org/10.1155/2017/6926485.
[95] van Leeuwen R, Boekhoorn S, Vingerling JR, Witteman JCM, Klaver CCW, Hofman A, et al. Dietary intake of antioxidants and risk of age-related macular degeneration. JAMA 2005;294:3101–7. https://doi.org/10.1001/jama.294.24.3101.
[96] Chew EY, Clemons TE, Agrón E, Sperduto RD, SanGiovanni JP, Kurinij N, et al. Long-Term Effects of Vitamins C, E, Beta-Carotene and Zinc on Age-Related Macular Degeneration. AREDS Report No. 35. Ophthalmology 2013;120:1604-1611.e4. https://doi.org/10.1016/j.ophtha.2013.01.021.
[97] Wong P, Markey M, Rapp CM, Darrow RM, Ziesel A, Organisciak DT. Enhancing the efficacy of AREDS antioxidants in light-induced retinal degeneration. Mol Vis 2017;23:718–39.
[98] Tan JSL, Wang JJ, Flood V, Rochtchina E, Smith W, Mitchell P. Dietary antioxidants and the long-term incidence of age-related macular degeneration: the Blue Mountains Eye Study. Ophthalmology 2008;115:334–41. https://doi.org/10.1016/j.ophtha.2007.03.083.
[99] Blasiak J, Pawlowska E, Chojnacki J, Szczepanska J, Chojnacki C, Kaarniranta K. Zinc and Autophagy in Age-Related Macular Degeneration. International Journal of Molecular Sciences 2020;21:4994. https://doi.org/10.3390/ijms21144994.
[100] Anderson LA, Hakojarvi SL, Boudreaux SK. Zinc acetate treatment in Wilson’s disease. The Annals of Pharmacotherapy 1998;32:78–87.
[101] Hoogenraad TU, Van Hattum J, Van den Hamer CJ. Management of Wilson’s disease with zinc sulphate. Experience in a series of 27 patients. J Neurol Sci 1987;77:137–46. https://doi.org/10.1016/0022-510x(87)90116-x.
[102] Socha P, Janczyk W, Dhawan A, Baumann U, D’Antiga L, Tanner S, et al. Wilson’s Disease in Children: A Position Paper by the Hepatology Committee of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2018;66:334–44. https://doi.org/10.1097/MPG.0000000000001787.
[103] Yee BE, Richards P, Sui JY, Marsch AF. Serum zinc levels and efficacy of zinc treatment in acne vulgaris: A systematic review and meta-analysis. Dermatol Ther 2020;33:e14252. https://doi.org/10.1111/dth.14252.
[104] Tolino E, Skroza N, Mambrin A, Proietti I, Bernardini N, Balduzzi V, et al. An Open-label Study Comparing Oral Zinc to Lymecycline in the Treatment of Acne Vulgaris. J Clin Aesthet Dermatol 2021;14:56–8.
[105] Jagadeesan S, Kaliyadan F. Acrodermatitis Enteropathica. StatPearls, Treasure Island (FL): StatPearls Publishing; 2024.
[106] Akhondzadeh S, Mohammadi M-R, Khademi M. Zinc sulfate as an adjunct to methylphenidate for the treatment of attention deficit hyperactivity disorder in children: a double blind and randomized trial [ISRCTN64132371]. BMC Psychiatry 2004;4:9. https://doi.org/10.1186/1471-244X-4-9.
[107] Arnold LE, DiSilvestro RA, Bozzolo D, Bozzolo H, Crowl L, Fernandez S, et al. Zinc for attention-deficit/hyperactivity disorder: placebo-controlled double-blind pilot trial alone and combined with amphetamine. J Child Adolesc Psychopharmacol 2011;21:1–19. https://doi.org/10.1089/cap.2010.0073.
[108] Toren P, Eldar S, Sela BA, Wolmer L, Weitz R, Inbar D, et al. Zinc deficiency in attention-deficit hyperactivity disorder. Biol Psychiatry 1996;40:1308–10. https://doi.org/10.1016/S0006-3223(96)00310-1.
[109] Granero R, Pardo-Garrido A, Carpio-Toro IL, Ramírez-Coronel AA, Martínez-Suárez PC, Reivan-Ortiz GG. The Role of Iron and Zinc in the Treatment of ADHD among Children and Adolescents: A Systematic Review of Randomized Clinical Trials. Nutrients 2021;13:4059. https://doi.org/10.3390/nu13114059.
[110] Talebi S, Miraghajani M, Ghavami A, Mohammadi H. The effect of zinc supplementation in children with attention deficit hyperactivity disorder: A systematic review and dose-response meta‑analysis of randomized clinical trials. Crit Rev Food Sci Nutr 2022;62:9093–102. https://doi.org/10.1080/10408398.2021.1940833.
[111] Leonard MB, Zemel BS, Kawchak DA, Ohene-Frempong K, Stallings VA. Plasma zinc status, growth, and maturation in children with sickle cell disease. J Pediatr 1998;132:467–71. https://doi.org/10.1016/s0022-3476(98)70022-8.
[112] Zemel BS, Kawchak DA, Fung EB, Ohene-Frempong K, Stallings VA. Effect of zinc supplementation on growth and body composition in children with sickle cell disease. The American Journal of Clinical Nutrition 2002;75:300–7. https://doi.org/10.1093/ajcn/75.2.300.
[113] Prasad AS. Zinc deficiency in patients with sickle cell disease. The American Journal of Clinical Nutrition 2002;75:181–2. https://doi.org/10.1093/ajcn/75.2.181.
[114] Swe KMM, Abas ABL, Bhardwaj A, Barua A, Nair NS. Zinc supplements for treating thalassaemia and sickle cell disease. Cochrane Database Syst Rev 2013;6:CD009415. https://doi.org/10.1002/14651858.CD009415.pub2.
[115] Wang J, Um P, Dickerman BA, Liu J. Zinc, Magnesium, Selenium and Depression: A Review of the Evidence, Potential Mechanisms and Implications. Nutrients 2018;10. https://doi.org/10.3390/nu10050584.
[116] Petrilli MA, Kranz TM, Kleinhaus K, Joe P, Getz M, Johnson P, et al. The Emerging Role for Zinc in Depression and Psychosis. Front Pharmacol 2017;8:414. https://doi.org/10.3389/fphar.2017.00414.
[117] Maes M, De Vos N, Demedts P, Wauters A, Neels H. Lower serum zinc in major depression in relation to changes in serum acute phase proteins. J Affect Disord 1999;56:189–94. https://doi.org/10.1016/s0165-0327(99)00011-7.
[118] Li Z, Li B, Song X, Zhang D. Dietary zinc and iron intake and risk of depression: A meta-analysis. Psychiatry Res 2017;251:41–7. https://doi.org/10.1016/j.psychres.2017.02.006.
[119] Yosaee S, Clark CCT, Keshtkaran Z, Ashourpour M, Keshani P, Soltani S. Zinc in depression: From development to treatment: A comparative/ dose response meta-analysis of observational studies and randomized controlled trials. Gen Hosp Psychiatry 2022;74:110–7. https://doi.org/10.1016/j.genhosppsych.2020.08.001.
[120] Terrin G, Berni Canani R, Di Chiara M, Pietravalle A, Aleandri V, Conte F, et al. Zinc in Early Life: A Key Element in the Fetus and Preterm Neonate. Nutrients 2015;7:10427–46. https://doi.org/10.3390/nu7125542.
[121] Staub E, Evers K, Askie LM. Enteral zinc supplementation for prevention of morbidity and mortality in preterm neonates. Cochrane Database Syst Rev 2021;3:CD012797. https://doi.org/10.1002/14651858.CD012797.pub2.
[122] Wilson RL, Grieger JA, Bianco-Miotto T, Roberts CT. Association between Maternal Zinc Status, Dietary Zinc Intake and Pregnancy Complications: A Systematic Review. Nutrients 2016;8:641. https://doi.org/10.3390/nu8100641.
[123] Carducci B, Keats EC, Bhutta ZA. Zinc supplementation for improving pregnancy and infant outcome. Cochrane Database Syst Rev 2021;3:CD000230. https://doi.org/10.1002/14651858.CD000230.pub6.
[124] Nasiadek M, Stragierowicz J, Klimczak M, Kilanowicz A. The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients 2020;12:2464. https://doi.org/10.3390/nu12082464.
[125] Zhao J, Dong X, Hu X, Long Z, Wang L, Liu Q, et al. Zinc levels in seminal plasma and their correlation with male infertility: A systematic review and meta-analysis. Sci Rep 2016;6:22386. https://doi.org/10.1038/srep22386.
[126] Kanafchian M, Mahjoub S, Esmaeilzadeh S, Rahsepar M, Mosapour A. Status of serum selenium and zinc in patients with the polycystic ovary syndrome with and without insulin resistance. Middle East Fertility Society Journal 2018;23:241–5. https://doi.org/10.1016/j.mefs.2017.11.003.
[127] Foroozanfard F, Jamilian M, Jafari Z, Khassaf A, Hosseini A, Khorammian H, et al. Effects of zinc supplementation on markers of insulin resistance and lipid profiles in women with polycystic ovary syndrome: a randomized, double-blind, placebo-controlled trial. Exp Clin Endocrinol Diabetes 2015;123:215–20. https://doi.org/10.1055/s-0035-1548790.
[128] Jamilian M, Foroozanfard F, Bahmani F, Talaee R, Monavari M, Asemi Z. Effects of Zinc Supplementation on Endocrine Outcomes in Women with Polycystic Ovary Syndrome: a Randomized, Double-Blind, Placebo-Controlled Trial. Biol Trace Elem Res 2016;170:271–8. https://doi.org/10.1007/s12011-015-0480-7.
[129] Afshar Ebrahimi F, Foroozanfard F, Aghadavod E, Bahmani F, Asemi Z. The Effects of Magnesium and Zinc Co-Supplementation on Biomarkers of Inflammation and Oxidative Stress, and Gene Expression Related to Inflammation in Polycystic Ovary Syndrome: a Randomized Controlled Clinical Trial. Biol Trace Elem Res 2018;184:300–7. https://doi.org/10.1007/s12011-017-1198-5.
[130] Kashefi F, Khajehei M, Tabatabaeichehr M, Alavinia M, Asili J. Comparison of the effect of ginger and zinc sulfate on primary dysmenorrhea: a placebo-controlled randomized trial. Pain Manag Nurs 2014;15:826–33. https://doi.org/10.1016/j.pmn.2013.09.001.
[131] Zekavat OR, Karimi MY, Amanat A, Alipour F. A randomised controlled trial of oral zinc sulphate for primary dysmenorrhoea in adolescent females. Aust N Z J Obstet Gynaecol 2015;55:369–73. https://doi.org/10.1111/ajo.12367.
[132] Sangestani G, Khatiban M, Marci R, Piva I. The Positive Effects of Zinc Supplements on the Improvement of Primary Dysmenorrhea and Premenstrual Symptoms: A Double-blind, Randomized, Controlled Trial. Journal of Midwifery and Reproductive Health 2015;3:378–84. https://doi.org/10.22038/jmrh.2015.4463.
[133] Farrah AM, Halim B, Kaban Y. Effectiveness of Zinc Supplementation in Treating Dysmenorrhea. Bali Med J 2017;6:34. https://doi.org/10.15562/bmj.v6i1.380.
[134] Teimoori B, Ghasemi M, Hoseini ZSA, Razavi M. The Efficacy of Zinc Administration in the Treatment of Primary Dysmenorrhea. Oman Med J 2016;31:107–11. https://doi.org/10.5001/omj.2016.21.
[135] Fathizadeh S, Amani R, Haghighizadeh MH, Hormozi R. Comparison of serum zinc concentrations and body antioxidant status between young women with premenstrual syndrome and normal controls: A case-control study. International Journal of Reproductive Biomedicine 2016;14:699.
[136] Chuong CJ, Dawson EB. Zinc and copper levels in premenstrual syndrome. Fertil Steril 1994;62:313–20. https://doi.org/10.1016/s0015-0282(16)56884-8.
[137] Siahbazi S, Behboudi-Gandevani S, Moghaddam-Banaem L, Montazeri A. Effect of zinc sulfate supplementation on premenstrual syndrome and health-related quality of life: Clinical randomized controlled trial. J Obstet Gynaecol Res 2017;43:887–94. https://doi.org/10.1111/jog.13299.
[138] Jafari F, Amani R, Tarrahi MJ. Effect of Zinc Supplementation on Physical and Psychological Symptoms, Biomarkers of Inflammation, Oxidative Stress, and Brain-Derived Neurotrophic Factor in Young Women with Premenstrual Syndrome: a Randomized, Double-Blind, Placebo-Controlled Trial. Biol Trace Elem Res 2020;194:89–95. https://doi.org/10.1007/s12011-019-01757-9.
[139] Ahmad R, Shaju R, Atfi A, Razzaque MS. Zinc and Diabetes: A Connection between Micronutrient and Metabolism. Cells 2024;13:1359. https://doi.org/10.3390/cells13161359.
[140] Fernández-Cao JC, Warthon-Medina M, Hall Moran V, Arija V, Doepking C, Lowe NM. Dietary zinc intake and whole blood zinc concentration in subjects with type 2 diabetes versus healthy subjects: A systematic review, meta-analysis and meta-regression. J Trace Elem Med Biol 2018;49:241–51. https://doi.org/10.1016/j.jtemb.2018.02.008.
[141] Jayawardena R, Ranasinghe P, Galappatthy P, Malkanthi R, Constantine G, Katulanda P. Effects of zinc supplementation on diabetes mellitus: a systematic review and meta-analysis. Diabetol Metab Syndr 2012;4:13. https://doi.org/10.1186/1758-5996-4-13.
[142] Wang X, Wu W, Zheng W, Fang X, Chen L, Rink L, et al. Zinc supplementation improves glycemic control for diabetes prevention and management: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr 2019;110:76–90. https://doi.org/10.1093/ajcn/nqz041.
[143] Heidari Seyedmahalleh M, Montazer M, Ebrahimpour-Koujan S, Azadbakht L. The Effect of Zinc Supplementation on Lipid Profiles in Patients with Type 2 Diabetes Mellitus: A Systematic Review and Dose-Response Meta-Analysis of Randomized Clinical Trials. Adv Nutr 2023;14:1374–88. https://doi.org/10.1016/j.advnut.2023.08.006.
[144] Hamedifard Z, Farrokhian A, Reiner Ž, Bahmani F, Asemi Z, Ghotbi M, et al. The effects of combined magnesium and zinc supplementation on metabolic status in patients with type 2 diabetes mellitus and coronary heart disease. Lipids Health Dis 2020;19:112. https://doi.org/10.1186/s12944-020-01298-4.
[145] Mahmoud HM, Ali AF, Al-Timimi DJ. Relationship Between Zinc Status and DNA Oxidative Damage in Patients with Type 2 Diabetes Mellitus. Biol Trace Elem Res 2021;199:1276–9. https://doi.org/10.1007/s12011-020-02267-9.
[146] Gezondheidsraad. Voedingsnormen voor vitamines en mineralen voor volwassenen 2018:34.
[147] EFSA. Dietary reference values | Tolerable upper intake levels for vitamins and minerals | EFSA 2006. https://www.efsa.europa.eu/en/topics/topic/dietary-reference-values (accessed September 17, 2024).
[148] EFSA. Dietary Reference Values for zinc | EFSA 2014. https://www.efsa.europa.eu/en/efsajournal/pub/3844 (accessed September 16, 2024).
[149] Linus Pauling Institute. Zinc. Linus Pauling Institute 2014. https://lpi.oregonstate.edu/mic/minerals/zinc (accessed September 18, 2024).
[150] Lomaestro BM, Bailie GR. Absorption interactions with fluoroquinolones. 1995 update. Drug Saf 1995;12:314–33. https://doi.org/10.2165/00002018-199512050-00004.
[151] Penttilä O, Hurme H, Neuvonen PJ. Effect of zinc sulphate on the absorption of tetracycline and doxycycline in man. Eur J Clin Pharmacol 1975;9:131–4. https://doi.org/10.1007/BF00614009.
[152] Palmery M, Saraceno A, Vaiarelli A, Carlomagno G. Oral contraceptives and changes in nutritional requirements. Eur Rev Med Pharmacol Sci 2013;17:1804–13.
[153] Alexander J, Tinkov A, Strand TA, Alehagen U, Skalny A, Aaseth J. Early Nutritional Interventions with Zinc, Selenium and Vitamin D for Raising Anti-Viral Resistance Against Progressive COVID-19. Nutrients 2020;12:2358. https://doi.org/10.3390/nu12082358.
[154] Graham RD, Knez M, Welch RM. How Much Nutritional Iron Deficiency in Humans Globally Is due to an Underlying Zinc Deficiency? Advances in Agronomy, vol. 115, Elsevier; 2012, p. 1–40. https://doi.org/10.1016/B978-0-12-394276-0.00001-9.